Giải bài 24 hóa học 12: Thực hành Tính chất, điều chế kim loại, sự ăn mòn kim loại
Theo dõi 1.edu.vn trênNội dung bài học gồm hai phần:
- Lý thuyết về tính chất, điều chế kim loại, sự ăn mòn kim loại
- Giải thí nghiệm SGK
A. Lý thuyết
1. Tính chất của kim loại
a, Tính chất hóa học chung
- Các kim loại đều có tính khử: $M\rightarrow M^{n+}+ne$
Vi dụ:
- Tác dụng với phi kim:
2Fe + Cl2 $\overset{t^{0}}{\rightarrow}$ 2FeCl3
4Al + O2 $\overset{t^{0}}{\rightarrow}$ 2Al2O3
- Tác dụng với dung dịch axit:
Fe + 2HCl → FeCl2 + H2
3Cu + HNO3 loãng → 3CuSO4 + 2NO↑ + 4H2O
- Tác dụng với nước: kim loại nhóm IA và IIA
2Na + 2H2O → 2NaOH + H2↑
- Tác dụng với dung dịch muối:
Fe + CuSO4 → FeSO4 + Cu
b, Dãy điện hóa của kim loại
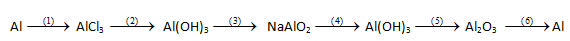
- Dãy điện hoá cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hoá - khử: chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.
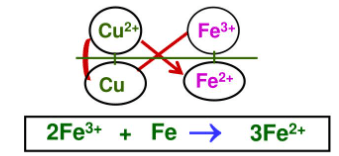
Ví dụ: Dự đoán chiều của phản ứng giữa 2 cặp oxi hóa - khử $Cu^{2+}/Cu$ và $Fe^{3+}/Fe^{2+}$
2. Điều chế kim loại và sự ăn mòn kim loại
a, Điều chế kim loại
- Trong công nghiệp, kim loại được điều chế bằng phương pháp nhiệt luyện:
Ví dụ: PbO + H2 $\overset{t^{0}}{\rightarrow}$ Pb + H2O
- Trong phòng thí nghiệm, kim loại được điều chế bằng phương pháp thủy luyện: Dùng kim loại mạnh khử ion kim loại yếu trong dung dịch
Ví dụ: Fe + CuSO4 → FeSO4 + Cu↓
- Phương pháp điện phân: Điện phân nóng chảy và điện phân dung dịch:
Ví dụ: 2Al2O3 $\overset{đpnc}{\rightarrow}$ 4Al + 3O2↑
CuCl2 $\overset{đpdd}{\rightarrow}$ Cu + Cl2
b, Ăn mòn kim loại
Gồm hai loại là:
- Ăn mòn hoá học là quá trình oxi hoá - khử, trong đó các electron của kim loại được chuyển trực tiếp các chất trong môi trường.
- Ăn mòn điện hoá hoc là quá trình oxi hoá - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
Ví dụ: Nhúng thanh kẽm và đồng vào dung dịch H2SO4 loãng , nối thanh kẽm với thanh đồng. Kẽm bị ăn mòn, bọt khí H2 thoát ra ở thanh Cu.
Cực âm (anot) Zn → Zn2+ + 2e
Cực dương (catot) 2H+ + 2e → H2↑
- Điều kiện để xảy ra ăn mòn điện hoá học:
+ Các điện cực phải khác nhau về bản chất.
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
+ Các điện cực cùng tiếp xúc với dung dịch chất điện li.
B. Giải các thí nghiệm SGK trang 104
B. Bài tập & Lời giải
Thí nghiệm 1: Dãy điện hóa của kim loại
- Quan sát, so sánh lượng bọt khí hiđro thoát ra ở các ống nghiệm trên.
- Rút ra kết luận và mức độ hoạt đông của các kim loại.
Xem lời giải
Thí nghiệm 2: Điều chế kim loại bằng cách dùng kim loại mạnh khử ion của kim loại yếu trong dung dịch
- Quan sát hiện tượng.
- Rút ra kết luận và viết phương trình hóa học.
Xem lời giải
Thí nghiệm 3: Ăn mòn điện hóa học
- Quan sát bọt khí thoát ra.
- So sánh lượng bọt khí thoát ra ở hai ống . Rút ra kết luận và giải thích.